Det Hydrogenbinding er en interaktion mellem molekyler, der ligner Van der Waals-interaktioner og forekommer i den menneskelige krop. Bindingen spiller en rolle især i forbindelse med peptidbindinger og kæder af aminosyrer i proteiner. Uden evnen til at binde med brintbindinger er en organisme ikke levedygtig, fordi den mangler vitale aminosyrer.
Hvad er brintbindingen?

Hydrogenbindinger kaldes Hydrogenbindinger eller H broer forkortet. Det er en kemisk virkning, der vedrører den attraktive vekselvirkning mellem kovalent bundne hydrogenatomer med frie elektronpar af et atomgrupperingsatom. Interaktionen er baseret på polaritet og består, for at være mere præcis, mellem de positivt polariserede hydrogenatomer i en amino- eller hydroxylgruppe og frie elektronpar i andre funktionelle grupper.
Interaktionen finder kun sted under visse omstændigheder. En betingelse er den elektronegative egenskab hos de frie elektronpar. Denne egenskab skal være stærkere end den elektronegative egenskab ved brint for at skabe en stærk binding. Hydrogenatom kan således bindes polært. Elektronegativt frie atomer kan for eksempel være nitrogen, ilt og fluor.
Hydrogenbindinger er sekundære valensbindinger, hvis styrke normalt er langt under den for kovalente bindinger eller ioniske bindinger. Molekyler i brintbindinger har et relativt højt smeltepunkt og et lignende højt kogepunkt i forhold til deres molære masse. Bindingerne er primært af medicinsk betydning i forhold til peptiderne og nukleinsyrerne i en organisme.
Hydrogenbindinger er intermolekylære kræfter. Uden deres eksistens ville vand ikke eksistere i forskellige samlede tilstande, men ville være gasformigt.
Funktion & opgave
Hydrogenbindingen har kun svag interaktion og forekommer mellem to partikler eller inden i molekyler. I denne sammenhæng spiller typen af binding en rolle, for eksempel til dannelse af tertiære strukturer i proteiner. I biokemi betyder proteinstruktur de forskellige strukturelle niveauer af et protein eller peptid. Strukturerne af disse naturligt forekommende stoffer er hierarkisk opdelt i en primær struktur, en sekundær struktur, en tertiær struktur og en kvartær struktur.
Aminosyresekvensen er den primære struktur. Hver gang et protein nævnes i relation til dets rumlige arrangement, henvises der ofte til proteinkonformationer og fænomenet med konformationel ændring. I denne sammenhæng svarer ændringen i konformation til en ændring i den rumlige struktur. Arrangementet af proteiner er baseret på peptidbindingen. Denne type binding forbinder altid aminosyrer på samme måde.
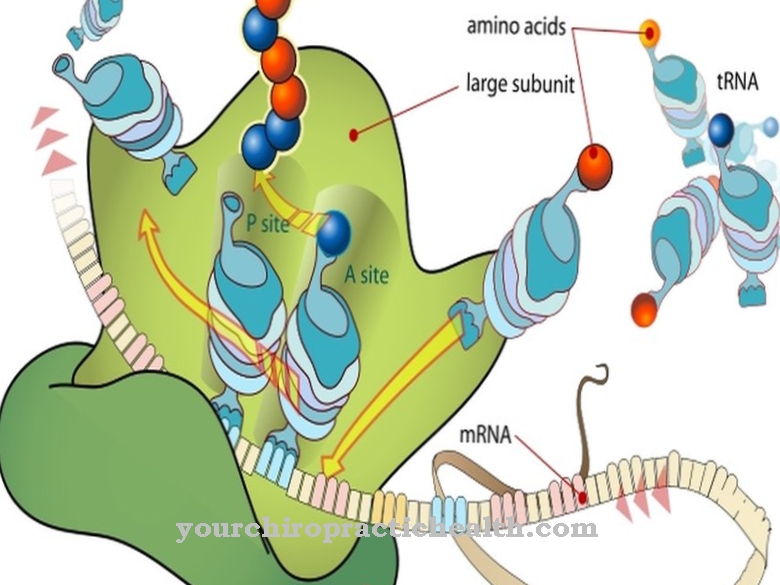
I celler medieres peptidbindinger af ribosomer. Hver peptidbinding svarer til en forbindelse af carboxylgrupper af en aminosyre og aminogrupper af en anden aminosyre, som er forbundet med eliminering af vand. Denne proces er også kendt som hydrolyse.
I hver peptidbinding forbinder en enkeltbinding en C = O-gruppe med en NH-gruppe. Kvælstofatom har nøjagtigt et enkelt par elektroner. På grund af den høje elektronegativitet af ilt er dette frie par under elektron-tilbagetrækning af O2-atomer. På denne måde trækker ilt delvist det ene par elektroner ind i bindingen mellem nitrogenatomet og carbonatomet, og peptidbindingen får en delvis dobbeltbindingskarakter. Dobbeltbindingskarakteren eliminerer fri rotation af NH- og C = O-grupperne.
Oxygenatomer og hydrogenatomer i peptidbindinger er relevante for strukturdannelsen af alle peptider og proteiner uden undtagelse. På denne måde kan to aminosyrer bindes til hinanden. Efter en sådan tilknytning er alle peptidbindinger i to kæder af aminosyrer direkte overfor hinanden. Hydrogenatomerne i peptidbindingen er relativt positivt polariseret sammenlignet med oxygenatomerne i de direkte modsatte peptidbindinger. På denne måde danner og forbinder brintbindinger de to aminosyrekæder med hinanden.
Alle aminosyrer i den menneskelige krop er organiske forbindelser, der består af mindst en carboxygruppe og en aminogruppe. Aminosyrer er en væsentlig strukturel komponent i menneskets liv. Foruden a-aminosyrerne i proteiner kendes mere end 400 ikke-proteinogene aminosyrer med biologiske funktioner, der ikke kunne opstå uden hydrogenbinding. Kræfter såsom hydrogenbinding stabiliserer aminosyrernes tertiære struktur.
Du kan finde din medicin her
➔ Medicin mod muskelsvaghedSygdomme og lidelser
Hvis der er en forstyrrelse i dannelsen af funktionelle protein-ergiske rumlige strukturer, tales man normalt om proteinfoldningssygdomme. En sådan tilstand er Huntingtons sygdom. Denne genetiske sygdom er arvet som en autosomal dominerende egenskab og skyldes en genetisk mutation i kromosom 4. Mutationen fører til en ustabilitet af genproduktet. Sygdommen er en neurologisk sygdom, der primært er forbundet med ufrivillig hyperkinesis i de distale ekstremiteter og ansigt. Vedvarende hyperkinesis fører til stivhed i de berørte muskler. Derudover lider patienter med sygdommen af øget energiforbrug.
Patologiske symptomer i forbindelse med brintbindinger eller den generelle proteinstruktur er også til stede i prionsygdomme, såsom madko-sygdom. I henhold til den mest populære hypotese inducerer BSE proteinfoldning. Disse sammenfoldede proteiner kan ikke nedbrydes ved fysiologiske processer og akkumuleres derfor i vævet, især i centralnervesystemet. Resultatet er degeneration af nervecellerne.
Misdannelser i proteinstrukturen diskuteres også i årsagssammenhængen mellem Alzheimers sygdom. De nævnte sygdomme påvirker ikke hydrogenbindingen direkte, men vedrører den rumlige struktur af proteiner, hvortil hydrogenbindingen yder et væsentligt bidrag.
En organisme med en absolut manglende evne til brintbinding er ikke levedygtig. En mutation, der forårsager dette, ville resultere i en abort i den tidlige graviditet.






.jpg)



.jpg)