Det Induceret-fit-Teorien går tilbage til Koshland og svarer til en udvidelse af nøglålsprincippet, der er baseret på nøjagtigheden af anatomiske strukturs pasform. Induceret pasform refererer til enzymer, såsom kinase, der ændrer deres konformation til at danne et enzymligand-kompleks. I tilfælde af enzymfejl kan det inducerede pasningsprincip påvirkes af forstyrrelser.
Hvad er induceret fit?

Mange processer i kroppen fungerer på nøglelåsen eller hånd-i-handske-princippet. Dette gælder for eksempel for artikulerede forbindelser. Fugthovedet går i indgreb i sokkelstikket som en nøgle i en lås eller en hånd i en handske. Døren åbnes kun, når nøglen er nøjagtigt i låsen. I samme sammenhæng åbnes visse funktioner i kroppen kun, når strukturer mødes nøjagtigt.
Induced-fit er en speciel form for key-in-lock-princippet. Dette er en teori for dannelse af protein-ligand-komplekser, for eksempel et enzym-substrat-kompleks i sammenhæng med enzym-katalyserede reaktioner.
Daniel E. Koshland anses for at være den første til at beskrive teorien og først postuleret den i 1958. I modsætning til nøglelåsprincippet antager den inducerede pasningsteori ikke to statiske strukturer. I tilfælde af protein-ligandkomplekser bør en konformationel ændring i det involverede protein muliggøre dannelse af komplekset. Ligand og protein, eller snarere enzym, Koshland betragtes som dynamisk og talte om en interaktion, der bevæger begge partnere til en ændring i konformationen af hensyn til kompleks dannelse.
Funktion & opgave
Der er bindingsspecificitet mellem enzymer og substrater. Denne bindende specificitet indebærer nøglelås-princippet. Hvert enzym har et aktivt center. Til kompleks dannelse med en ligand er dette centrum nøjagtigt formet på en sådan måde, at det næsten perfekt matcher den rumlige form på det tilsigtede underlag.
I tilfælde af mange enzymer er det aktive center imidlertid i begge tilfælde i en form, der ikke er særlig præcis, så længe det ikke er bundet til et underlag. Denne observation synes at være i modstrid med lock-and-key-princippet, fordi enzymer og deres ligander oprindeligt ser ud til at tilpasse deres form.
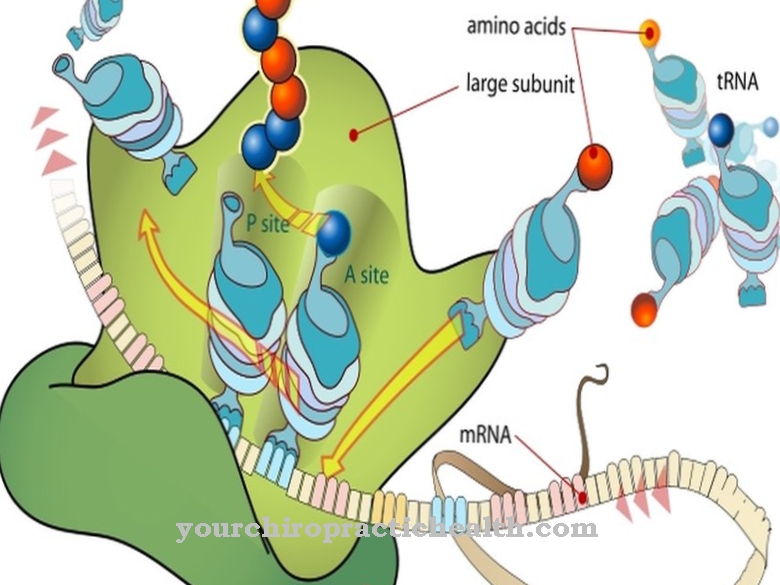
Så snart enzymet binder sig til en ligand, oprettes intermolekylære interaktioner. Disse interaktioner på det intermolekylære niveau fører til en ændring i enzymets konformation. Ved konformation forstås de forskellige mulige arrangementer af individuelle atomer i et molekyle, der er resultatet af en simpel rotation omkring en akse. Ændringen i konformation af enzymer svarer til en ændring i det rumlige arrangement af deres molekyler og muliggør kun dannelse af et enzym-substratkompleks.
Hexokinasen som enzymer katalyserer for eksempel det første trin i glykolyse. Så snart disse enzymer kommer i kontakt med substratglukosen, kan en induceret pasform i betydningen dannelse af en "induceret pasform" observeres. Enzymet hexokinase phosphorylerer dens ligandglukose ved at konsumere ATP til dannelse af et glucose-6-phosphat.
Vandstrukturen ligner strukturen i C6-atomets alkoholgruppe, som enzymet fosforylerer under reaktionen. På grund af den lille størrelse kunne vandmolekyler binde sig til det aktive centrum af enzymet, så hydrolyse af ATP ville blive genereret. Imidlertid tillader den inducerede pasform hexokinase at katalysere glukoseomdannelsen med høj specificitet, så ATP-hydrolyse skal finde sted i lille grad. Med den inducerede pasningsmekanisme øges substratspecificiteten.
Princippet i den menneskelige organisme kan overholdes især i tilfælde af kinaser. Den inducerede tilpasning gælder ikke for hvert ligand-receptorkompleks, da de konformationelle ændringer af begge parter i mange tilfælde er naturlige grænser.
Sygdomme og lidelser
Princippet om induceret pasform forstyrres i tilfælde af forskellige enzymdefekter. I phenylketonuri er for eksempel enzymer begrænset i deres aktivitet eller mislykkes fuldstændigt. Normalt skyldes dette en genetisk defekt. I phenylketonuria er enzymet phenylalanin hydroxylase defekt. Phenylalanin omdannes ikke længere til tyrosin og akkumuleres i overensstemmelse hermed. Neurotoksiske stoffer opstår, så patienten ud over psykiske handicap også har en tendens til krampe. Enzymdefekter er normalt genetiske og er forårsaget af en forkert kodet aminosyresekvens i DNA'et.
Metabolske sygdomme forårsaget af enzymdefekter og et sådant forstyrret induceret fit-princip kaldes enzymopatier. Pyruvat-kinasedefekter er for eksempel til stede i et forkert kodende PKLR-gen. Dette gen er lokaliseret på gen locus 1q22 i kromosom 1. Forskellige mutationer af PKLR-allelen af pyruvatkinase er kendt, der viser sig som defekter i R-form.
Hers sygdom kaldes igen glycogenose type VI og hører til gruppen af glycogenlagringssygdomme. Det er en autosomal recessiv eller X-bundet metabolisk lidelse på grund af enzymdefekter. Mere præcist ligger årsagen i forskellige enzymdefekter i phosphorylasekinasesystemet i leveren og musklerne. I denne sammenhæng er for eksempel den X-bundne phosphorylase-b-kinase-defekt i leveren, leverfosforylasedefekten af den autosomale recessive arv og den kombinerede fiasko af phosphorylase-b-kinase i leveren og musklerne kendt.
I forbindelse med leverphosphorylase blev de forårsagende mutationer lokaliseret på PYGL-genet og er derfor på kromosom 14q21 til q22. Den kombinerede levermuskelfosforylase-mangel er blevet knyttet til mutationer i PHKB-genet på locus 16q12-q13. Årsags mutationer i PHKA2-genet på locus Xp22.2-p22.1 blev identificeret for den X-bundne defekt i leverphosphorylasekinase. Andre glycogenoser kan også annullere den inducerede pasningseffekt af den tilsvarende kinase eller gøre det vanskeligere.







.jpg)



.jpg)