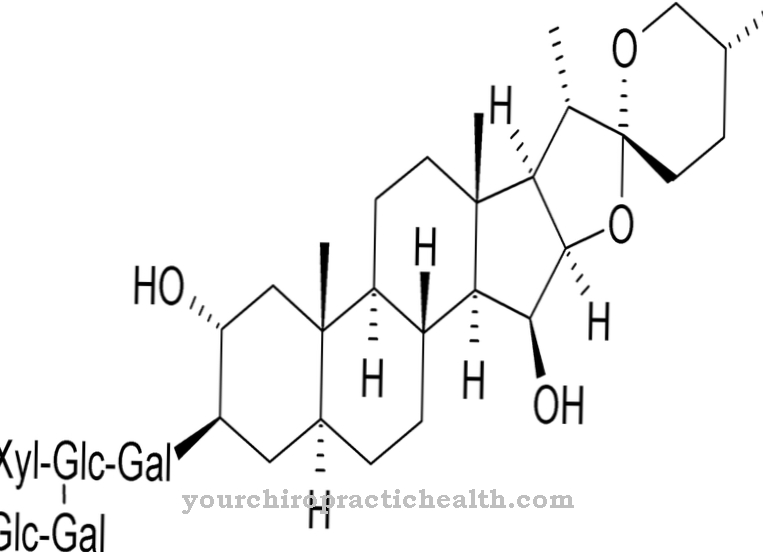
hydroxylysin er en ikke-klassisk proteinogen aminosyre. Det inkorporeres i det tilsvarende protein som lysin og hydrolyseres til hydroxylysin i polypeptidet ved hjælp af et enzym. Det er en af hovedkomponenterne i kollagenproteinerne i bindevæv.
Hvad er hydroxylysin?
Hydroxylysin er en proteinogen aminosyre, der først inkorporeres i et protein som lysin. Derfor er det en ikke-kanonisk proteinogen aminosyre. Udtrykket "kanonisk" betyder klassisk.
Så der er ingen kodon for denne aminosyre. Hydroxylysin findes hovedsageligt i bindevævskollagen og i glycoproteiner. Der omdannes lysin til hydroxylysin via enzymatiske processer. Kun en del af lysinet omdannes til hydroxylysin. Egenskaberne af de respektive collagener afhænger af mængden af hydrolyseret lysin og prolinrester.
Hydroxylysin kan isoleres i fri form som hydrochlorid. Hydrochloridet af hydroxylysin er et beige pulver med et smeltepunkt på 225 til 230 grader. Det er en basisk aminosyre, der også får hydroxylysinholdige proteiner til at reagere basiske. Hydroxylysin blev opdaget af den amerikanske biokemiker og medstifter af "Clinical Chemistry" Donald Van Slyke (1883-1971).
Funktion, effekt og opgaver
Hydroxylysin er af stor betydning for bindevævets struktur. Glycoproteiner indeholder også hydroxylysin for at danne glycosidiske forbindelser af proteinet med sukkerrester på hydroxylresten.
Inden i kollagenet er det ansvarlig for tværbinding af de individuelle proteinmolekyler. Sammen med hydroxylprolin, den hydrolyserede form af prolin, er det også medvirkende til at opbygge de tertiære og kvartære strukturer af kollagen. Hydroxyleringen af lysin katalyseres af enzymet lysylhydroxylase med deltagelse af cofaktorer jernioner og askorbinsyre (C-vitamin). Fordelingsmønsteret for de hydroxylerede lysinrester i kollagen er hverken særlig stift eller fleksibel. Der er altid tilbagevendende mønstre.
Der er imidlertid også hele områder i proteinet, der ikke indeholder hydroxylerede lysinrester. Mens hydroxyprolin er ansvarlig for den spiralformede struktur af kollagen gennem bindingen af tre proteinkæder, dannes tværbindinger mellem de forskellige proteinmolekyler via hydroxylgrupperne i hydroxylysinen. Derudover tjener disse molekylære grupper også som et bindingssted for en glykosidbinding med et sukker. Alt i alt sikrer dette styrken af bindevævet.
Hvis der er en mangel på hydroxylysin i proteinerne, kan dette ikke afhjælpes ved et yderligere indtag af aminosyren. Der er ikke noget kodon for fri hydroxylysin, så det ikke kan inkorporeres i det tilsvarende protein. Værdien af kosttilskud med tilsat hydroxylysin er derfor meget tvivlsom. Derfor skal mangelen skyldes utilstrækkelig hydroxylering af lysin.
Uddannelse, forekomst, egenskaber & optimale værdier
Hydroxylysin findes kun i kollagen hos mennesker og dyr. Der er også nogle glycoproteiner, der også indeholder hydroxylysin. Dette inkluderer adiponectin. Adiponectin er et hormon, der produceres i fedtvæv og har en afgørende indflydelse på effektiviteten af insulin. Hydroxylysin er også blevet påvist i nogle bakterier, såsom Staphylococcus aureus.
Fordelingen af det hydroxylerede lysin er ikke ensartet i kollagen. Der er steder, hvor det næsten altid findes. I andre områder findes hydroxylysin næsten aldrig. Denne ujævne fordeling bestemmer kollagenets struktur. Inden i den tredobbelte helixstruktur af kollagen er hydroxylysin altid placeret i Y-positionen for den gentagne sekvens Gly-X-Y. I de korte regioner med en ikke-spiralformet struktur forekommer hydroxylysin også andre steder.
Sygdomme og lidelser
Bindevevet er absolut afhængig af tilstedeværelsen af hydroxylysin. Kollagen kan kun være stabilt og fast, hvis tværbindingerne mellem proteinmolekylerne fungerer. En mangel på hydroxylysin forårsager bindevevssvaghed.
Hvis den kun er til stede i ekstremt små mængder eller slet ikke, ville den tilsvarende organisme ikke være levedygtig. Bindevevet kunne ikke længere udføre sin opgave som et begrænsende og understøttende væv til organerne. Der er faktisk sygdomme, der kan spores tilbage til en mangel på hydroxylysin. Da denne aminosyre oprindeligt er inkorporeret som lysin under proteinsyntese, kan den ikke være en primær mangel. Hydroxylysin dannes fra lysin i kollagenproteinet ved hjælp af lysylhydroxylaser. En hydroxylysinmangel kan kun skyldes en defekt i dette enzym eller dets utilstrækkelige funktion.
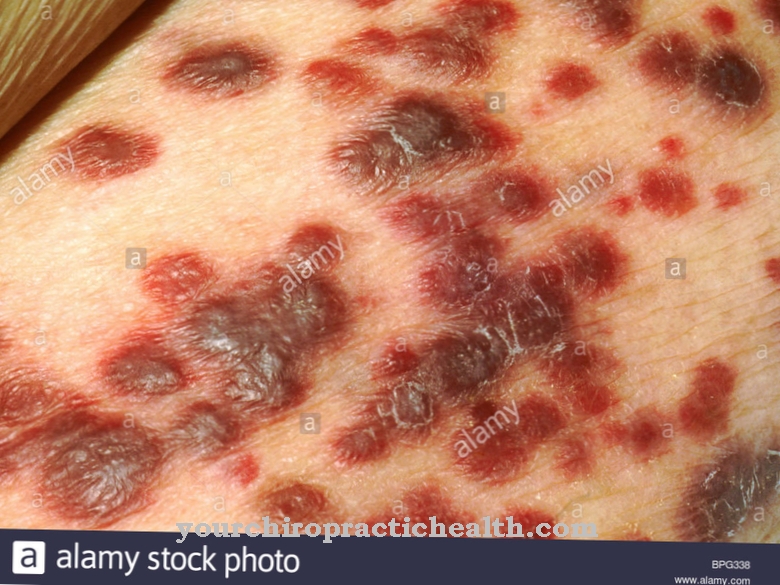
Der er en gruppe af heterogene medfødte bindevævssvagheder, der er kendt som Ehlers-Danlos syndrom. Et antal mutationer kan være ansvarlige for dette kliniske billede. Blandt andet kan lysylhydroxylasen også være defekt, således at der for lidt lysin hydroxyleres. Ehlers-Danlos syndrom manifesterer sig gennem overstrækbarhed af huden og overmotoritet i leddene. Indre organer, blodkar, sener, ledbånd og muskler påvirkes også. Prognosen afhænger af sværhedsgraden af defekten. Hvis skibene er involveret, forventes et ugunstigt kursus. Den fuldstændige fiasko af enzymet lysylhydroxylase er uforenelig med liv og observeres derfor ikke.
Men selv med et intakt enzym kan der være svagt bindevæv på grund af dets lave aktivitet. Lysylhydroxylase kræver jernioner og ascorbinsyre (C-vitamin) som cofaktorer. Hvis der for eksempel mangler C-vitamin, forekommer det, der kaldes skørbug. Skørbug er en erhvervet bindevevssygdom forårsaget af mangel på hydroxylgrupper på prolin- og lysinresterne af kollagen. Årsagen er den lave aktivitet af prolinhydroxylase og lysinhydroxylase på grund af ascorbinsyremangel.














.jpg)