Fibronectin er et glucoprotein og spiller en vigtig rolle i at holde kroppens celler sammen eller i blodkoagulation. Det påtager sig mange forskellige funktioner i organismen, som er relateret til dens evne til at udvikle klæbekræfter. Strukturelle fejl i fibronektins struktur kan føre til alvorlig svaghed i bindevævet.
Hvad er fibronektin?
Fibronectin er et glucoprotein med en molekylvægt på 440 kDa (kilodalton). Det bruges til at udvikle klæbekræfter mellem celler, mellem kropsceller og forskellige underlag, mellem kropsceller og den intercellulære matrix og mellem blodplader under blodkoagulation. Det understøtter derfor sårheling, embryogenese, hæmostase, celleadhæsion under cellemigration eller antigenbinding til fagocytter.
Den primære fibronectin indeholder 2355 aminosyrer og danner 15 isoformer. Det forekommer både i det ekstracellulære område og i kropsceller. Uden for cellerne er det et uopløseligt protein. Inde i celleplasmaet er det et opløseligt protein. Alle fibronektinformer kodes af det samme FN1-gen. Det opløselige fibronectin indeholder to isomere proteinkæder, der er forbundet med en disulfidbro. I tilfælde af uopløselig fibronectin er disse molekyler bundet til hinanden via disulfidbroer til dannelse af en fibrillignende struktur.
Anatomi & struktur
I sin basale struktur er fibronectin en heterodimer, der består af to stavlignende proteinkæder, som er forbundet med en disulfidbro. De isomere proteinkæder udtrykkes af det samme gen, FN1-genet. Den forskellige basesekvens skyldes alternativ splejsning af dette gen. Hvert gen indeholder eksoner og introner. Eksoner er sektioner, der oversættes til proteinstrukturen. I modsætning hertil er introner inaktive gensegmenter. Ved alternativ splejsning forbliver sekvensen af baseparene den samme, men eksoner og introner findes på forskellige gensegmenter. Når man oversætter den genetiske information, slås de læsbare eksoner sammen, og intronerne udskæres. Denne alternative oversættelse af den samme genetiske information muliggør dannelse af adskillige isomere proteinkæder fra det samme gen.
Fibronectin, der består af to isomere proteinkæder, er opløselig, dannes i leveren og kommer ind i blodplasmaet. Der er det ansvarlig for koagulering af blod som en del af sårheling og vævsregenerering. Det uopløselige fibronectin produceres i makrofager, endotelceller eller fibroblaster. Det indeholder den samme grundlæggende struktur. Her er de individuelle fibronektinmolekyler imidlertid på sin side forbundet til hinanden ved disulfidbroer for at danne fibrillære proteinstrukturer, der holder cellerne sammen.
Evnen til at udvikle klæbekræfter skyldes den ofte forekommende aminosyresekvens arginin - glycin - aspartat. Dette fører til vedhæftning af fibronectin til såkaldte integriner (adhæsionsreceptorer på overfladen af cellerne). Proteinkæderne i fibronectin består af mange domæner, der indeholder 40 til 90 aminosyrer. På grund af domænes homologi er fibronectin-polypeptidkæderne opdelt i de tre strukturelle typer I, II og III.
Funktion & opgaver
Fibronectin tjener generelt til at holde visse strukturelle enheder sammen. Disse inkluderer cellerne, den ekstracellulære matrix, visse underlag eller endda blodplader. Tidligere blev der kaldt fibronektin Celle lim udpeget. Det sikrer, at cellerne i vævet forbliver sammen og ikke driver fra hinanden.
Det spiller også en vigtig rolle i cellevandring. Selv docking af makrofager med antigener er medieret af fibronectin. Endvidere kontrollerer fibronectin mange processer med embryogenese og celledifferentiering.
Dog reduceres fibronectin ofte i ondartede tumorer. Dette gør det muligt for tumoren at vokse ind i vævet og danne metastaser ved at opdele tumorceller.
Det opløselige fibronektin i blodplasmaet muliggør dannelse af blodpropper for at lukke blødende sår. De individuelle blodplader limes sammen gennem dannelsen af fibrin. Som opsonin binder fibronectin sig til overfladen af makrofager som receptorer. Ved hjælp af disse receptorer kan makrofagerne binde og inkorporere visse sygdomsfremkaldende partikler. I det ekstracellulære rum er uopløseligt fibronectin ansvarlig for dannelsen af en matrix, der fikserer cellerne.
sygdomme
Mangel eller strukturelle abnormiteter i fibronectin har ofte alvorlige helbredsvirkninger. Som et resultat af kræftvækst i tumoren falder fibronectin-koncentrationen. Cellestrukturen i tumoren løsner, og cellerne bevæger sig fra hinanden. Dette fører til de hyppige metastaser på grund af opdeling af tumorceller og deres migration gennem lymfesystemet eller blodplasma til andre dele af kroppen. På grund af manglen på fibronectin kan kræftcellerne desuden vokse hurtigere ind i det nærliggende væv og således fortrænge det.
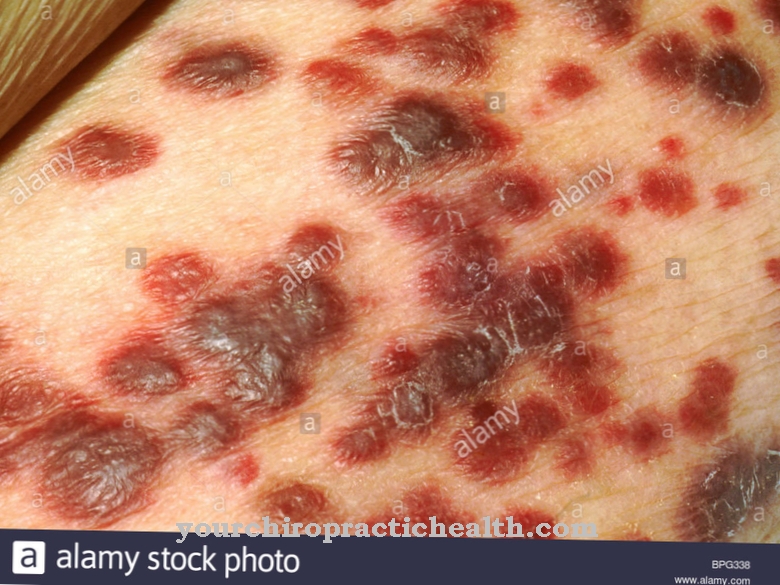
Der er desuden arvelige sygdomme, der fører til en defekt i bindevævet. Et eksempel er Ehlers-Danlos syndrom. Ehlers-Danlos-syndromet er ikke en ensartet sygdom, men repræsenterer snarere et kompleks af bindevævsfejl. Type X er forårsaget af manglende eller mangelfuld fibronektin. Det er en mutation i FN1-genet. Dette fører til en drastisk svaghed i bindevævet. Betingelsen er arvet som en autosomal recessiv egenskab. Det manifesterer sig i en meget slapp hud og overmotoritet i leddene. På trods af store forskelle i årsagen til det svage bindevæv er symptomerne på de individuelle sygdomme i dette kompleks ens. Ifølge den danske hudlæge Edvard Ehlers og den franske hudlæge Henri-Alexandre Danlos er de kardinalsymptomer på Ehlers-Danlos syndrom den svære overstrækbarhed og teabarbarhed i huden.
Endelig kan en bestemt mutation i FN1-genet også føre til glomerulopati (sygdomme i nyrecorpuskler). Dette er en alvorlig nyresygdom, der ofte kræver dialysebehandling.













.jpg)