Det Aldehyde-oxidase er et enzym, der nedbryder aldehyder i hvirveldyr. Det findes i forskellige væv fra pattedyr og mennesker. Den nøjagtige funktion af aldehydoxidasen er endnu ikke kendt.
Hvad er aldehydoxidase?
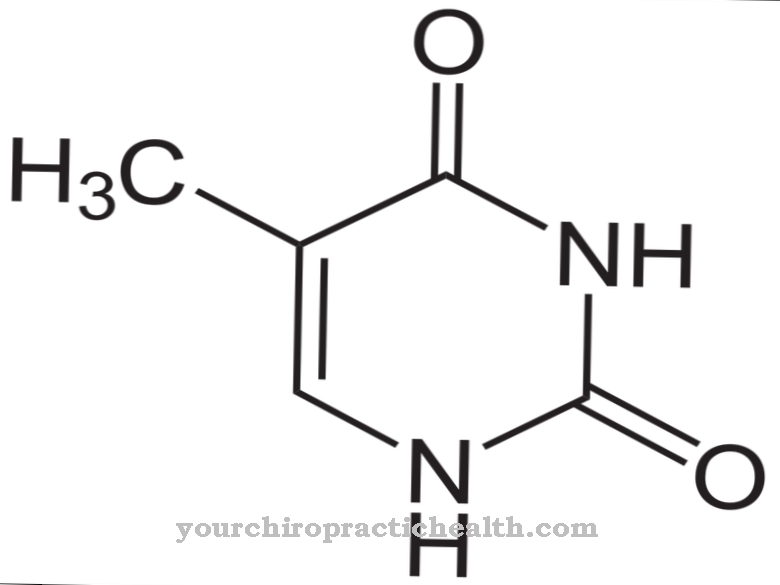
Aldehyde oxidase (AOX1) hjælper med den enzymatiske nedbrydning af aldehyder i kroppen. Det blev imidlertid fundet, at det også nedbryder nikotin til cotinin. Et iltatom er indbygget i det iltfrie nikotin for at danne en aldehydstruktur.
På grund af denne kendsgerning er aldehydoxidasen også vigtig for tryptophanmetabolismen og på samme tid for biotransformationen. Det findes hovedsageligt i cytosol i levercellerne, bugspytkirtlen, lungerne, knoglemusklerne eller fedtcellerne. Kofaktormolybdæn er meget vigtig for enzymets aktivitet. Der er kun et AOX-gen i humant DNA, der kan kode et funktionelt enzym. Flere AOX-gener er aktive i andre hvirveldyr. Aldehydeoxidase ligner meget og er relateret til enzymet xanthine dehydrogenase.
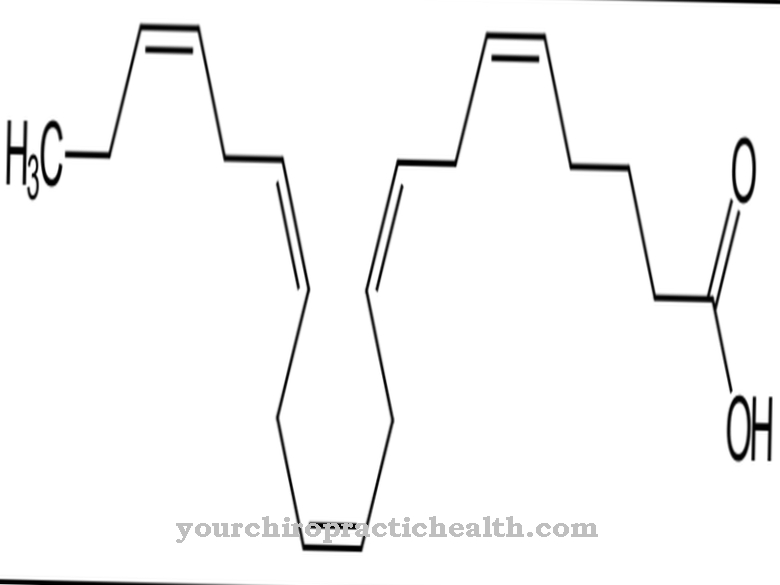
Begge enzymer kan omdanne hypoxanthin til xanthine ved at absorbere et iltatom og et vandmolekyle. Konverteringen af xanthine til urinsyre foregår imidlertid kun gennem xanthinehydrogenase (xanthine oxidase). Aldehydoxidasen består af 1338 aminosyrer. Molybdopterin, FAD og 2 (2Fe2S) tjener som kofaktorer for deres effektivitet. Reaktionen, der allerede er kendetegnet ved navnet, karakteriserer omdannelsen af aldehyder med tilsætning af ilt og vand til carboxylsyrer og hydrogenperoxid.
Funktion, effekt og opgaver
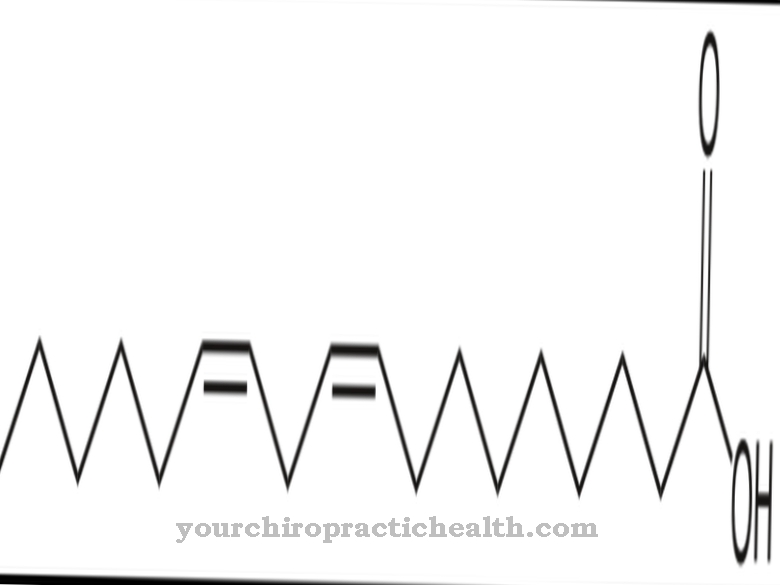
Enzymet aldehydoxidase katalyserer adskillige reaktioner. For det meste er det ansvarlig for omdannelsen af aldehyder til carboxylsyrer med tilsætning af ilt og vand. Generelt medierer aldehydoxidase tilsætningen af et oxygenatom til et substrat.
Det katalyserer blandt andet også omdannelsen af nikotin til conitin. Derfor spiller det også en vigtig rolle i biotransformation og tryptophan metabolisme. Molybdæn er altid påkrævet som en cofaktor i disse reaktioner. Som en del af biotransformationen omdanner den xenobiotika med aldehydgrupper til de tilsvarende carboxylsyrer i fase I-reaktionen. I fase II-reaktionen er glukuronsyre bundet til carboxylgrupperne for at øge vandopløseligheden for at skylle det fremmede molekyle ud af kroppen.
Strukturelt og kemisk er aldehydoxidase tæt forbundet med den homologe enzym xanthinhydrogenase (xanthinoxidase). Det er imidlertid ikke kendt, hvorfor omdannelsen af xanthin til urinsyre med tilsætning af ilt og vand kun katalyseres af xanthineoxidase. Konverteringen af hypoxanthin til xanthine katalyseres stadig af begge enzymer. Derudover er aldehydoxidase også ansvarlig for adipogenese (reproduktion af fedtceller).
Det stimulerer sekretionen af vævshormonet adiponectin. Adiponectin øger på sin side effektiviteten af insulin. I hepatocytterne hæmmer adiponectin igen frigørelsen af aldehydoxidase. En mangel på aldehydoxidase (AOX1) hæmmer også lipideksport fra cellerne. Den nøjagtige funktion af aldehydoxidasen er endnu ikke fuldt ud forstået.
Uddannelse, forekomst, egenskaber & optimale værdier
Aldehydeoxidase findes hovedsageligt i levercellernes cytoplasma. Det findes dog også i fedtceller, lungevæv, knoglemuskler og bugspytkirtlen. Det forblev forvekslet med den homologe xanthinoxidase.
Begge enzymer har en lignende struktur. Dog katalyserer de undertiden forskellige reaktioner. Begge enzymer har brug for de samme kofaktorer for deres funktion. Disse er molybdopterin, FAD og 2 (2Fe2S). Aldehydoxidase nedbryder imidlertid ikke kun aldehyder, men er også ansvarlig for oxidation af N-heterocykliske forbindelser, såsom nikotin til cotinin.
Sygdomme og lidelser
Sammen med xanthine dehydrogenase (xanthine oxidase) og sulfitoxidase er aldehydoxidase afhængig af cofaktormolybdæn. Molybdæn er indbygget i et molybdopterin som et komplekst atom og danner molybdæncofaktor. I tilfælde af en molybdænmangel fungerer disse tre enzymer dårligt.
Xanthine dehydrogenase katalyserer opdelingen af xanthine til urinsyre. Enzymet aldehydoxidase er kun delvist involveret i denne proces, for eksempel når hypoxanthine opdeles i xanthin. Her konkurrerer den endda med xanthinoxidase. Der er derfor ingen isoleret aldehydoxidase-mangel. Aldehydoxidase understøtter dog nedbrydningen af catecholamines. Sulfitoxidasen er ansvarlig for nedbrydningen af svovlholdige aminosyrer, såsom cystein, taurin eller methionin. Hvis dette enzym mangler, omdannes sulfit ikke længere til sulfat. På grund af cofaktormolybdæn har de tre enzymer normalt en fælles mangel.
Naturligvis er isolerede defekter på grund af mutationer mulige for hver af disse enzymer. Imidlertid er intet klinisk billede med en specifik aldehydoxidase-mangel blevet beskrevet indtil videre. En molybdænmangel induceret af en ubalanceret diæt er meget sjælden. Dette kan dog ske med parenteral ernæring, der er lavt i molybdæn i mere end seks måneder. I sådanne tilfælde er tachypnea, tachycardia, svær hovedpine, kvalme, opkast, central ansigtshindring eller koma ofte. Der er desuden intolerancer over for visse aminosyrer. Forhøjede sulfitkoncentrationer findes i urinen, mens nedsatte urinsyreværdier findes i blodet.
Hvis molybdænmangel fortsætter, kan det føre til problemer med nedbrydningen af svovlholdige aminosyrer, sulfitallergier, hårtab, lave blodsyrer i blodet og fertilitetsproblemer. De fleste af symptomerne skyldes imidlertid sulfitoxidase og xanthine dehydrogenase-mangel. Takykardien skyldes sandsynligvis øgede niveauer af adrenalin eller noradrenalin (catecholamines), da deres nedbrydning er forsinket af manglen på aldehydoxidase. En molybdænmangel kan være forårsaget af en diæt, der er ekstremt lav i molybdæn og i inflammatoriske tarmsygdomme, såsom Crohns sygdom med malabsorption af mad.
En arvelig molybdænkofaktormangel på grund af nedsat syntese af molybdopterin er dødelig, hvis alle tre enzymer mislykkes uden behandling.





.jpg)