Trypsin Som et enzym i bugspytkirtlen er det ansvarligt for den yderligere nedbrydning af madproteiner. Det fungerer i det stærkt alkaliske område. Trypsinmangel fører til proteinmangel i kroppen på grund af den forringede fordøjelse af proteiner.
Hvad er trypsin?
Trypsin er en protease, der fortsætter nedbrydningen af proteiner i det alkaliske område af tyndtarmen. I maven begynder proteinnedbrydning i det sure miljø af enzymet pepsin. Enzymet trypsin består af tre komponenter.
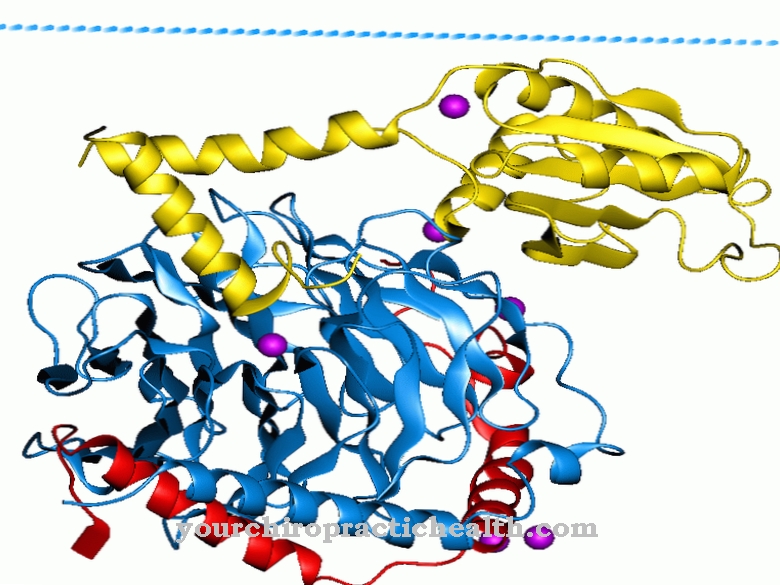
Disse er trypsin-1 som kation, trypsin-2 som anion og trypsin-4. To tredjedele af enzymet består af trypsin-1 og en tredjedel af trypsin-2. Trypsin-4 eller mesotrypsin findes kun i små mængder. Trypsin er en endoprotease. Det opdeler kun et protein nogle steder. Det er også en serinprotease. Dets aktive center indeholder den katalytiske triade af asparaginsyre, histidin og serin. Det opdeler fortrinsvis diætproteinerne ved de basiske aminosyrer lysin, arginin og modificeret cystein.
Trypsin produceres fra zymogenforløberen trypsinogen ved hjælp af den katalytiske virkning af tarmenzymets enteropeptidase. Enzymet består af 224 aminosyrer. Trypsin udvikler sin optimale effekt ved en pH-værdi på 7 til 8.
Funktion, effekt og opgaver
Trypsins opgave er at fortsætte nedbrydningen af proteiner, der allerede er startet i maven i det alkaliske område. I maven begynder forfordøjelsen af madproteiner med det lignende enzym pepsin i det sure område.
Også her brydes proteinkæderne på bestemte punkter. Mens denne opdeling af proteiner finder sted i maven på aromatiske aminosyrer, såsom phenylalanin, opdeles proteinerne og polypeptiderne med trypsin på de basiske aminosyrer lysin og arginin såvel som på den modificerede cystein. En anden forskel for pepsin er, at trypsin udvikler sin optimale virkning i det basiske område ved en pH-værdi på 7 til 8. Aktiveret trypsin omdanner også andre zymogener, såsom chymotrypsinogen, pro-elastase, procarboxypeptidase og andre inaktive enzymer til aktive enzymer.
Konverteringen begynder umiddelbart efter frigivelsen af trypsin. De andre proteaser i bugspytkirtlen er chymotrypsin, carboxypeptidase eller elastin. Yderligere aktiverer trypsin sig selv ved at konvertere trypsinogen. Enheden i bugspytkirtlen er oprindeligt i deres inaktive form for ikke at nedbryde bugspytkirtlen gennem selvfordøjelse. Først når de inaktive præforme udskilles, kan de aktiveres ved opdeling. Først og fremmest katalyseres omdannelsen af trypsinogen til trypsin af enteropeptidasen. Det er den eneste funktion af enteropeptidase.
En hexamer med den terminale aminosyrelysin opdeles fra trypsinogen. Da trypsin også opdeler polypeptidkæder på det basiske lysin, katalyserer det nu også sin egen aktivering og samtidig aktivering af de andre zymogener. Sammen med enzymerne chymotrypsin og elastase opdeler den større proteiner i tyndtarmen og peptonerne (polypeptidkæder) produceret ved virkning af pepsin i tri- og dipeptider. Disse mindre peptider opdeles derefter yderligere i aminosyrer ved hjælp af andre enzymer. Især bidrager trypsin også til nedbrydningen af aminosyren methionin. Lysin stimulerer blandt andet dannelsen af trypsin.
Uddannelse, forekomst, egenskaber & optimale værdier
Trypsin er et endogent enzym, der bruges til at fordøje madproteiner. Derfor udskilles den altid af bugspytkirtlen kort efter at have spist. Imidlertid kan enzymet også opnås fra dyrekilder og anvendes medicinsk. Den proteinsplittende effekt kan blandt andet bruges til at nedbryde kroppens egne proteinkomplekser. Sådan kan immunkomplekser løses ved autoimmune sygdomme.
Betændelse i muskuloskeletalsystemet kan også behandles godt med trypsin. Det aktiverer også enzymet plasmin fra plasminogen. Plasmin opløser fibrin, når der er stærk trombedannelse. Trombose kan behandles eller endda forhindres ved hjælp af trypsin. Trypsin understøtter også fordøjelsen, når den tages under måltider. Hvis det påføres 1 til 2 timer før eller efter et måltid, udvikler det dens antiinflammatoriske virkninger.
Sygdomme og lidelser
I forbindelse med bugspytkirtleninsufficiens kan syntesen af fordøjelsesenzymer, såsom trypsin, begrænses. Konsekvensen er udviklingen af fordøjelsesbesvær. Ud over proteaser producerer bugspytkirtlen også lipaser og amylaser.
Hvis enzymer mangler, fordøjes fødevarekomponenterne ikke længere og havner i tyktarmen. Hvis der for eksempel mangler trypsin, kan proteinerne i kosten ikke længere fordøjes korrekt. Putrefaktive bakterier sætter sig i tyktarmen og nedbryder proteinerne anaerobt. Der er massive fordøjelsesproblemer med flatulens, diarré og mavesmerter. Endvidere fører den reducerede dannelse af aminosyrer til en proteinmangel og underernæring på trods af tilstrækkeligt madindtag. Enzymerne kan imidlertid også leveres udefra.
Der er imidlertid også medicinske nødsituationer, hvor kroppens egne enzymer, såsom trypsin, fordøjer selve bugspytkirtlen. Dette kan ske, hvis galdekanalerne og bugspytkirtlen er blokeret. Trypsin frigives, men kan ikke komme ind i tyndtarmen gennem blokeringen af bugspytkirtlen. Hvis bugspytkirtelkanalen ikke åbnes i denne akutte nødsituation, vil resultatet være dødeligt på grund af selvopløsningen af bugspytkirtlen. Selv med bugspytkirteltumorer kan pancreaskanalen være helt eller delvist lukket. Virkningen af fordøjelsessafterne i bugspytkirtlen manifesterer sig som kronisk eller akut pancreatitis.
Manglende trypsin kan også være forårsaget af en mutation. Der er desuden også arvelige former for pancreatitis, når nedbrydningen af trypsin er svækket.














.jpg)