Proteinet tropomyosin forekommer primært i de striede muskler og deltager i muskelsammentrækning. Genetiske mutationer kan påvirke strukturen af de producerede tropomyosinmolekyler og derved forårsage en række sygdomme - inklusive forskellige former for kardiomyopati samt arthrogryposis multiplex congenita og nemalin myopati.
Hvad er tropomyosin?
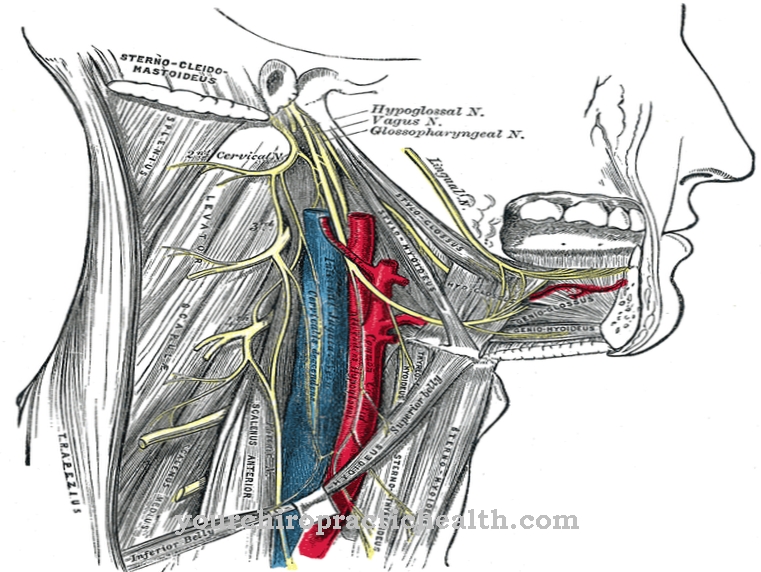
Tropomyosin er et protein, der primært findes i den menneskelige krop i knoglemusklerne. Biokemisten Kenneth Bailey beskrev først proteinet i 1946. En enkelt muskel består af mange muskelfiberbundter, som igen består af muskelfibrene.
Hver fiber er ikke sammensat af en enkelt, klart defineret muskelcelle, men af et væv med mange cellekerner. Inden for disse enheder repræsenterer myofibrillerne finere fibre; deres tværgående sektioner kaldes sarcomerer. En sarcomere består af to typer tråde, der skiftevis skubbes ind i hinanden, som et gear eller lynlås. Nogle af disse strenge er myosin, de andre er et kompleks af actin og tropomyosin. I dette komplekse danner actinmolekyler en tyk kæde, hvormed to tromler af tropomyosin vikles.
Anatomi & struktur
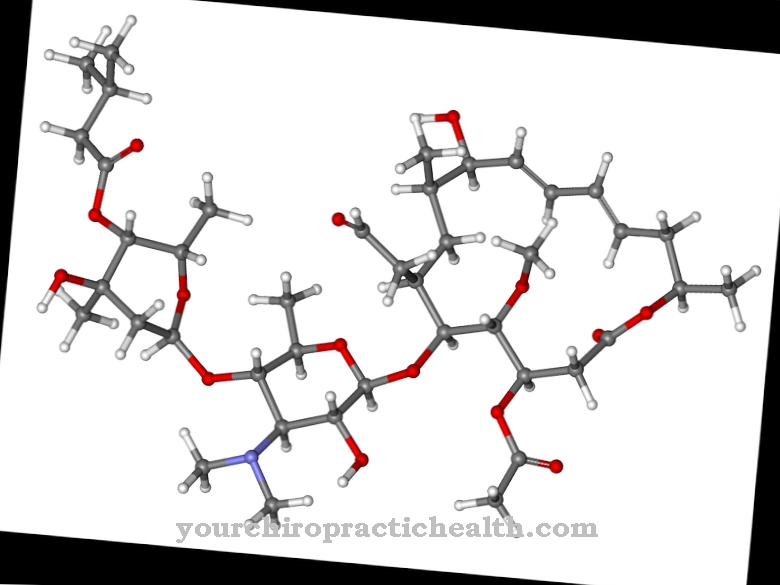
Tropomyosin består af to dele: α og β. De to byggesten har i alt 568 aminosyrer, hvoraf 284 er a-tropomyosin og 284 er β-tropomyosin. Disse aminosyrer stiller sig op i række og danner lange kæder, inden de omsider går sammen og danner et stavformet makromolekyle.
Sekvensen af aminosyrerne og proteinets struktur bestemmes genetisk; hos mennesker er følgende gener ansvarlige for dette: TPM1 på det 15. kromosom, TPM2 på det 9. kromosom, TPM3 på det første kromosom og TMP4 på det 19. kromosom. Tropomyosin-strengen (med begge underenheder) snor sig omkring de tykkere aktinfilamenter i de striede skeletmuskler. Troponin, et andet protein, er også knyttet til det.
Funktion & opgaver
Tropomyosin er påkrævet for, at knoglemusklerne trækkes sammen. Når en nerveimpuls når musklen, spreder den elektriske stimulus oprindeligt sig gennem sarcolemma og T-tubuli og fører til sidst til frigivelse af calciumioner i det sarkoplasmatiske retikulum.
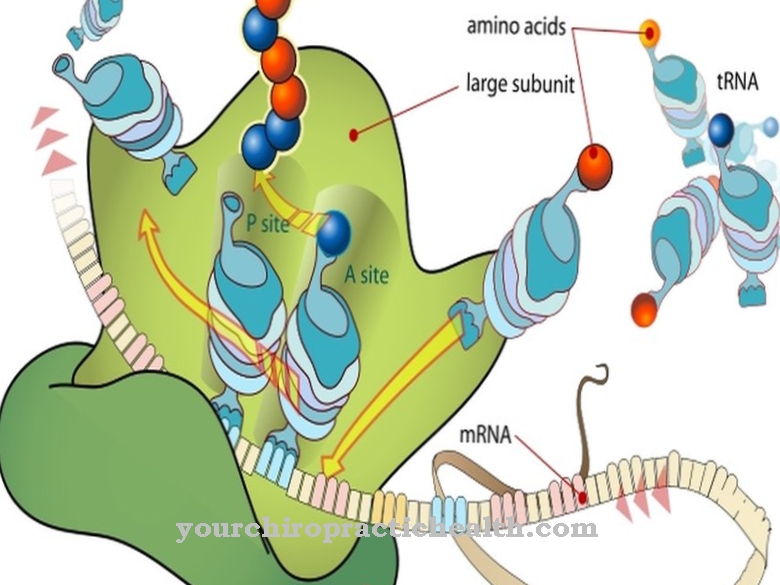
Iionerne binder midlertidigt til troponinet, som er placeret på tropomyosinstrengen. Som et resultat ændrer calciumionerne de fysiske egenskaber af molekylet. Troponinet skifter lidt på overfladen og bevæger sig således væk fra de steder, som myosin også kan binde til. Myosin danner de komplementære fibre til actin / tropomyosin-komplekset. I slutningen af myosintråden er der to såkaldte hoveder. Myosinhovederne kan binde til de områder af actintråden, der ikke længere er besat af troponin.
Efter at de har sat sig fast på fiberen, foldes myosinhovederne og skubber sig mellem aktin / tropomyosin-filamenterne, hvilket forkorter sarkomeren. På samme tid sker denne proces ikke kun i en sarkomere, men i mange. De talrige sammensatte sarkomerer får derfor muskelfibre og dermed muskelen som helhed til at sammentrække. Et nervesignal stimulerer ofte flere hundrede muskelfibre. Den plastificerende virkning af adenosintrifosfat (ATP) gør det muligt for myosinhovedet at løsne sig fra actinet.
Sammentrækningen af de glatte muskler er noget anderledes. Glatte muskler omgiver organer hos mennesker eller findes i væggene i blodkar. Det kan sammensætte sig mere end striberede muskler. Mens knoglemusklerne har en stribet struktur, danner de glatte muskler en flad overflade bestående af individuelle celler. Foruden actin og tropomyosin har de glatte muskler caldesmon og calmodulin, to andre proteiner, hvis interaktion påvirker spændingerne i musklerne. Tropomyosin virker primært på calmodulin.
Derudover spiller tropomyosin også en rolle i andre biologiske processer. For eksempel ser det ud til at påvirke bindingen af actin i cytoskelettet og at have en effekt på celledelingen.
sygdomme
En sygdom, der kan være relateret til tropomyosin, er hypertrofisk kardiomyopati. Dette er en hjertesygdom, hvor sarkomererne (sektioner af muskelfibrene) fortykkes, hvilket også påvirker tykkelsen af muskelfibrene som helhed.
Som et resultat kan der udvikle symptomer som en følelse af tryk i brystet, svimmelhed, åndenød, synkope og anginaanfald. I dette tilfælde går de tilbage til funktionelle problemer i hjertemuskelen. Den mest almindelige årsag (40-60%) af hypertrofisk kardiomyopati ligger i generne: ændringer (mutationer) fører til fejl i den genetiske kode og følgelig til forkert syntese af proteiner. Dette kan også påvirke de forskellige proteiner, der udgør muskelfibre.
Ved restriktiv kardiomyopati bliver hjertemuskelen hærdet. Årsagen er et overskud af bindevæv. Restriktiv kardiomyopati fører til hjertesvigt, som typisk er kendetegnet ved åndedrætsforstyrrelser, ødemer, tør hoste, træthed, udmattelse, svimmelhed, synkope, hjertebanken og forskellige fordøjelsesbesvær. De berørte er mindre tilbøjelige til at blive forvirrede, lide af hukommelsesproblemer eller nedsat kognitiv ydelse. Dilateret kardiomyopati kan også skyldes en fejl i tropomyosin generne.
Når denne hjertesygdom manifesteres, er den ofte forbundet med global hjertesvigt og / eller progressiv venstre hjertesvigt. Derudover kan åndedrætsforstyrrelser, embolismer og hjertearytmier vises. To andre sygdomme, der kan være relateret til tropomyosin og delvis er baseret på mutationer, er nemalin-myopati, hvor musklerne kan forringes på mange måder, og arthrogryposis multiplex congenita, hvor leddene stivner. Imidlertid kan alle disse sygdomme også have andre årsager; mutationer i tropomyosingenerne er kun en mulighed.



.jpg)

.jpg)