Biokatalysatoren Sulfitoxidase forårsager omdannelse af giftige svovlforbindelser fra nedbrydningen af aminosyrer til ikke-toksiske sulfater.
Det er vigtigt og forekommer derfor i alle organismer. Hvis dens funktion forstyrres af en genetisk defekt, forekommer sulfitoxidase-mangel. For højt sulfitindhold i blodet kan også have negative virkninger hos ellers sunde patienter.
Hvad er sulfitoxidase?
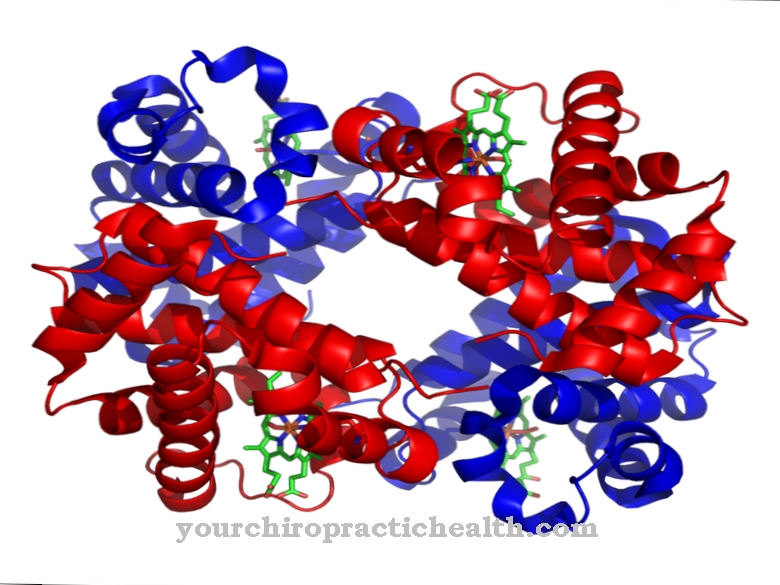
Sulfitoxidase (gennavn: SUOX) er navnet på et enzym, der indeholder molybdæn og består af 466 aminosyrer. Det hører til familien af xanthine dehydrogenases og forekommer i næsten alle organismer. Det indeholder molybdæn, et vigtigt sporelement, i midten.
Metallet forekommer der i sin biotilgængelige form som en molybdatanion. Sulfitoxidasen bruger den som en cofaktor (molybdat-molybdopterinforbindelse). Enzymet omdanner de svovlholdige aminosyrer methionin, cystein osv., Der indtages gennem mad, til uskadelige svovlsalte (sulfater), som derefter udskilles i urinen. Hos pattedyr forekommer den svovlnedbrydende biokatalysator primært i leveren og nyrerne. Enzymet sulfitoxidase sikrer, at blodets ilt kombineres med de essentielle aminosyrer og andre svovlstoffer.
Elektroner, der frigøres i processen, bruges til at producere ATP (adenosintrifosfat) via elektrontransportkæden. Enzymet katalyserer 10 gange mængden af sulfitter, der findes i en liter alkohol hver dag.
Funktion, effekt og opgaver
Alle bruger dagligt svovlholdige proteiner og fødevaretilsætningsstoffer. Sidstnævnte er fx indeholdt i syltede grøntsager, grapefrugtjuice osv. Og er beregnet til at beskytte fødevaren mod infektioner og misfarvning af mikrober. De danner bukettsubstanser i vin.
Nedbrydningen af cystein alene resulterer i 1680 mg giftig sulfit i kroppen hver dag, som straks skal konverteres af sulfitoxidasen, så organer og væv ikke beskadiges. Enzymet fungerer sammen med andre biokatalysatorer. Sulfitter er giftige og kan ødelægge vitale stoffer i kroppen og hæmme de nødvendige metaboliske processer, selv i de mindste mængder. For at udføre den vigtige afgiftning af cellerne har sulfitoxidasen brug for sporelementet molybdæn.
Mangel på dette metal kan føre til alvorlige konsekvenser. Et for højt niveau af kviksølv i kroppen kan også hæmme sulfitoxidas funktionalitet.
Uddannelse, forekomst, egenskaber & optimale værdier
Sulfitoxidase produceres hovedsageligt i mitokondrierne, cellernes "energicentre". Hos rotter forekommer for eksempel 80 procent af det i levercellemitokondrier. Derudover er det stadig stærkt repræsenteret i cellerne i nyrerne.
Molybdænoxidet, der kræves til aktiviteten af sulfitoxidase, er lokaliseret i det aktive centrum af enzymet. Som forskere for nylig har opdaget, kan molybdæntrioxid-nanopartikler erstatte det hos patienter med en molybdænmangel. De har en lignende katalytisk effekt i kroppen som det naturlige enzym. På denne måde kunne tidligere fatale sygdomme, såsom sulfocysteinuria, behandles.
Sygdomme og lidelser
En mangel på sulfitoxidase kan forårsage astmatiske og endda anafylaktiske reaktioner hos ellers sunde mennesker, da det parasympatiske nervesystem påvirker mastcellerne, der er ansvarlige for udviklingen af allergier.
Hvis sulfitoxidaseniveauet er for lavt, kan det desuden føre til alvorlig træthed, hovedpine og lavt blodsukkerniveau. Imidlertid har den genetiske mangel i det vitale enzym endnu værre konsekvenser. Den nyfødte er født med fysiske deformiteter og mentale handicap. Denne såkaldte sulfitoxidase-mangel eller sulfocysteinuria forekommer som en molybdæn cofactor (MoCo) -mangel sygdom i anslået 100.000 til 500.000 fødsler. Børn, der lider af en isoleret sulfitoxidase-defekt, viser lignende symptomer: svær encephalopati, knap kontrollerbare anfald, spastisitet, mikrocephali, muskelafslapning og progressiv hjernearofi.
Da den autosomale recessive, arvelige enzymmangel sygdom ikke i øjeblikket kan behandles effektivt, dør de små patienter normalt i barndommen: De svovlholdige forbindelser, der ikke er nedbrudt, giftige neuroner og myelinskeder i centralnervesystemet og akkumuleres i cellevæv. Allerede efter fødslen er der problemer med at spise og opkast i maveindholdet. Børnene fødes med en deformeret kraniet (udstående pande, dybderede øjne, overdrevent lange øjenlåg, tykke læber, lille næse). I løbet af de første par måneder af livet skifter objektivet i øjet.
Cirka 75 procent af de hidtil beskrevne tilfælde af sulfocysteinuria skyldes en MoCo-mangel: Alle tre enzymer, der er involveret i nedbrydningen af svovl i kroppen, sulfitoxidase, xanthinoxidase og aldehydoxidase, viser en stærkt reduceret aktivitet. En mutation i SUOX-genet (kromosom 12) er skylden for den isolerede sulfitoxidase-mangel. Det vises i tre varianter: type A (mutation i MOCS1-genet), type B (MOCS2-genet) og type C (MOCS3-genet). Mutation af type A er den mest almindelige. Dannelsen af forstadiemolekylet cPMP inhiberes. Imidlertid kan stoffet nu fremstilles og administreres på laboratoriet.For at forbedre overlevelsestiden for den børnepatient, bør mangelsygdommen diagnosticeres så hurtigt som muligt og behandles med daglige intravenøse indgivelser af molybdat.
Dette kan i det mindste indeholde yderligere skader. Barnet får antispasmodisk medicin til at bekæmpe anfaldene. De skal også have en diæt med lavt proteinindhold. Alternativt kan MoCo-forløber Z også administreres. Det reducerer anfald og forhindrer yderligere hjerneskade. Medicin har store forhåbninger til behandling af den tidligere uhelbredelige sygdom med molybdæntrioxid-nanopartikler, der tager rollen som sulfitoxidase i kroppen. For at finde ud af, om det ufødte barn har en sulfitoxidase-mangel, kan den gravide kontrollere sit S-sulfocystein-niveau i fostervand.

.jpg)
.jpg)
.jpg)


.jpg)


.jpg)