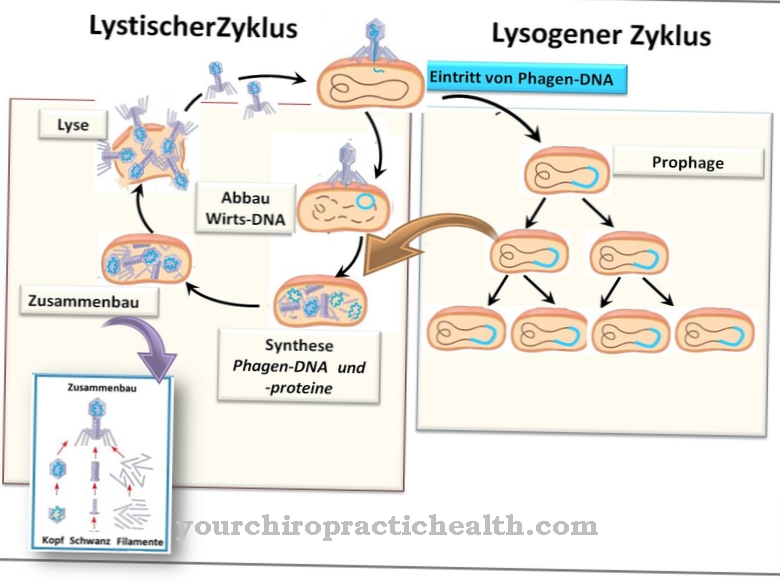
Det enteropeptidase er et enzym i duodenalslimhinden, hvis funktion er at aktivere bugspytkirtlenzymerne. Det står i starten af en hel aktiveringskaskade af fordøjelsesenzymer. Dysfunktion af enteropeptidase fører til maldigestion og malabsorption af mad i tyndtarmen.
Hvad er en enteropeptidase?
Enteropeptidase er et enzym i duodenalslimhinden, der aktiverer fordøjelsesenzymerne i bugspytkirtlen ved at aktivere trypsinogen til trypsin.
Enteropeptidase udskilles i børstens kant af tolvfingertarmsslimhinden. Specifikt er liebekühns kirtler ansvarlige for sekretion. Liebekühns kirtler er rørformede depressioner i det lille og store tarmepitel. I tyndtarmen er de placeret mellem tyndtarmen. Kirtlerne, også kendt som Lieberkühn krypter, udskiller et stort antal enzymer ud over enteropeptidase. Sekretionen af enteropeptidase stimuleres, når chymet, der er forudfordøjet i maven, kommer ind i tolvfingertarmen. Enzymet alene påvirker ikke fødevarekomponenterne.
Kun aktiveringen af enzymet trypsin sætter hele aktiveringskaskaden af fordøjelsesenzymerne i bevægelse. Enteropeptidase er ligesom trypsin og de andre proteaser i bugspytkirtlen en serinprotease. Det aktive center indeholder den katalytiske triade af asparaginsyre, histidin og serin. Som en endopeptidase spalter enteropeptidase kun proteinerne på visse karakteristiske punkter med visse genkendelsesmotiver i aminosyresekvensen. Enzymet spalter altid ved Asp-Asp-Asp-Asp-Lys genkendelsesmotivet. Med trypsinogen spaltes hexapeptidet Val- (Asp) 4-Lys, idet trypsin dannes.
Funktion, effekt og opgaver
Enteropeptidases funktion er at aktivere fordøjelsesenzymerne i bugspytkirtlen. Det initierer kun det første trin med aktivering med omdannelsen af trypsinogen til trypsin.
Trypsin er igen en serinprotease, der spalter proteiner baseret på det samme karakteristiske genkendelsesmotiv. Det fortsætter nu aktiveringen af selve trypsinogen. På samme tid aktiverer det andre pancreas-enzymer fra deres respektive forstadier, såsom chymotrypsinogen, pro-elastase, pro-carboxypeptidase, pro-phospholipase og proenteropeptidase. Enteropeptidase er også oprindeligt i den inaktive proform. Når chymet kommer ind i tolvfingertarmen, udskilles ikke kun proenteropeptidase, men også duodenase, hvilket aktiverer proformen af enteropeptidase. Efter starten af aktiveringskaskaden overtager trypsin aktiveringen af alle pancreas-enzymer inklusive proenteropeptidase og trypsinogen.
Aktiveringen af proenteropeptidase til enteropeptidase foregår endnu mere effektivt gennem virkningen af trypsin end gennem duodenase. Den primære tilstedeværelse af fordøjelsesenzymerne i deres inaktive form er ekstremt vigtig. Specielt proteasernes virkning er uspecifik. Alle proteiner, der indeholder det karakteristiske genkendelsesmotiv i molekylet, spaltes hydrolytisk. Hvis enzymerne straks var katalytisk aktive, ville kroppens egne proteiner allerede blive fordøjet i bugspytkirtlen og bugspytkirtlen. Som et resultat vil bugspytkirtlen opløse sig selv. Aktivering finder kun sted i tolvfingertarmen uden for de eksokrine kirtler.
Enzymerne kan begynde her med at nedbryde madkomponenterne uden at angribe kroppens eget væv. For at forhindre, at enzymerne aktiveres for tidligt, fungerer en yderligere trypsininhibitor i kanal i bugspytkirtlen. Trypsin spiller imidlertid nøglerollen for fordøjelseskaskaden. Når dette enzym er aktiveret, kan aktivering af alle fordøjelsesenzymer, inklusive enteropeptidase, ikke stoppes.
Uddannelse, forekomst, egenskaber & optimale værdier
Som alle serinproteaser har enteropeptidase også en ikke-specifik virkning og spalter proteinerne ved hjælp af et karakteristisk genkendelsesmotiv. Enteropeptidase består af en let og en tung kæde, der er forbundet med disulfidbroer. Serinproteasedomænet er placeret på den lette kæde.
Den tunge kæde har en molekylmasse på 82 til 140 kilodalton, med molekylmassen i den lette kæde er 35 til 62 kilodalton. Enteropeptidases lette kædestruktur svarer til de andre serinproteaser trypsin og chymotrypsin. Den tunge kæde er membranbundet og påvirker enzymets specificitet. Det blev fundet, at den isolerede lette kæde har en lignende virkning mod det karakteristiske genkendelsesmotiv - (Asp) 4-Lys-, men en signifikant lavere effekt mod trypsinogen.
Sygdomme og lidelser
Den humane enteropeptidase kodes af ENTK-genet på kromosom 21. En mutation af dette gen kan føre til alvorlige sygdomme hos de berørte børn.
Enzymet kan ikke længere aktivere de andre fordøjelsesenzymer. Fødevarekomponenterne brydes ikke længere ned og kan derfor ikke længere optages af tyndtarmen. Det er primært et spørgsmål om maldigestion (utilstrækkelig nedbrydning), som fører til malabsorption af fødevarekomponenterne. Kroppen er ikke længere tilstrækkelig med næringsstoffer. Manglende trivsel, afstemt vækst og typiske symptomer på proteinmangel ved udvikling af ødemer forekommer. Samtidig absorberes kulhydrater og fedtstoffer ud over proteiner dårligt. Da de ufordøjede fødevarekomponenter når tyktarmen og nedbrydes der ved gæring og putrefaktive bakterier, forekommer også flatulens, diarré og mavesmerter.
Indtil videre er 15 tilfælde af medfødt enteropeptidase-mangel beskrevet over hele verdenen. Imidlertid er symptomerne på tilstanden meget mere almindelige. En enteropeptidase-mangel behøver ikke altid at være til stede. Da trypsin spiller en nøglerolle i aktiveringen af fordøjelsesenzymer, fører en mangel eller mangel på trypsin også til lignende symptomer. Behandlingen af disse sygdomme er den samme i begge tilfælde. Enzymerne administreres i aktiveret form. Der er bestemt mange flere udiagnostiserede tilfælde af enteropeptidase-mangel.
Hvis diagnosen er sikker, kan enteropeptidase også erstattes. En enteropeptidase-mangel udløses også sekundært af svære tarmsygdomme.Sygdomme som cøliaki, forkortet tyndtarme, laktasemangel eller andre bør afklares i den differentierede diagnose.

.jpg)

.jpg)





.jpg)